Até o final do século XIX, o átomo era definido como uma unidade indivisível. Porém foram propostos diversos modelos atômicos que comprovaram o contrário: a existência de partículas subatômicas, em que descobriram que o átomo era dividido em uma região central e diversas órbitas circulares.

O entendimento desse conteúdo é fundamental, pois é a base para diversos outros assuntos. Se você avançar para conteúdos mais específicos sem entender a estrutura que forma os átomos, uma bola de neve será formada. Além disso, concursos, como o Enem, costuma cobrar algumas questões sobre o tema. Por isso, procuramos detalhar tudo que você precisa saber para ir bem nos vestibulares.
Toda matéria é formada de átomos, e cada elemento química apresentam átomos diferentes. O ferro (Fe) e o oxigênio (O) são exemplos de elementos químicos. O que torna um elemento químico único em mais de 100 deles e o que o torna único é a quantidade de prótons (determinadas partículas) que ele terá. Esse número irá definir seu número atômico e estabelecerá sua posição na tabela periódica.
A estrutura de um átomo é formada por 3 partículas: prótons (partículas com carga positiva), nêutrons (partículas neutras) e elétrons (partículas com carga negativa). Enquanto o núcleo do átomo representa praticamente toda sua massa e encontram-se os prótons e nêutrons, as órbitas (eletrosfera) possuem massa desprezível e estão os elétrons.
Portanto, a massa de um átomo pode ser calculada somando a massa dos prótons e dos nêutrons.
A = Z + n
onde:
A = massa;
Z = número atômico (número de prótons);
n = número de nêutrons.

É importante ressaltar que todos os átomos de um determinado elemento químico terão sempre a mesma quantidade de prótons. Como os prótons e elétrons apresentam cargas opostas, há uma força de atração entre eles e, portanto, a quantidade deles são a mesma.
Podemos identificar algumas características comuns em diferentes átomos e classificá-los em:
Isótopos: apresentam mesma quantidade de prótons, mas diferem no número de nêutrons e, consequentemente, apresentam massa diferente. Por exemplo:
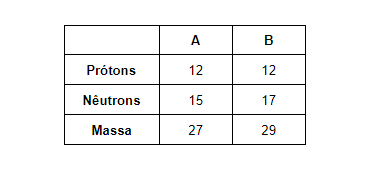
Isóbaros: apresentam mesma quantidade de massa, mas diferem no número atômico, ou seja, diferem no número de prótons. Por exemplo:
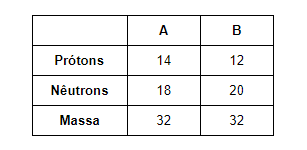
Isótonos: apresentam mesma quantidade de nêutrons, mas diferem na massa e no número atômico (número de prótons). Por exemplo:

Nos vemos novamente no próximo resumo ;)

O entendimento desse conteúdo é fundamental, pois é a base para diversos outros assuntos. Se você avançar para conteúdos mais específicos sem entender a estrutura que forma os átomos, uma bola de neve será formada. Além disso, concursos, como o Enem, costuma cobrar algumas questões sobre o tema. Por isso, procuramos detalhar tudo que você precisa saber para ir bem nos vestibulares.
Toda matéria é formada de átomos, e cada elemento química apresentam átomos diferentes. O ferro (Fe) e o oxigênio (O) são exemplos de elementos químicos. O que torna um elemento químico único em mais de 100 deles e o que o torna único é a quantidade de prótons (determinadas partículas) que ele terá. Esse número irá definir seu número atômico e estabelecerá sua posição na tabela periódica.
A estrutura de um átomo é formada por 3 partículas: prótons (partículas com carga positiva), nêutrons (partículas neutras) e elétrons (partículas com carga negativa). Enquanto o núcleo do átomo representa praticamente toda sua massa e encontram-se os prótons e nêutrons, as órbitas (eletrosfera) possuem massa desprezível e estão os elétrons.
Portanto, a massa de um átomo pode ser calculada somando a massa dos prótons e dos nêutrons.
A = Z + n
onde:
A = massa;
Z = número atômico (número de prótons);
n = número de nêutrons.
É importante ressaltar que todos os átomos de um determinado elemento químico terão sempre a mesma quantidade de prótons. Como os prótons e elétrons apresentam cargas opostas, há uma força de atração entre eles e, portanto, a quantidade deles são a mesma.
Podemos identificar algumas características comuns em diferentes átomos e classificá-los em:
Isótopos: apresentam mesma quantidade de prótons, mas diferem no número de nêutrons e, consequentemente, apresentam massa diferente. Por exemplo:
Isóbaros: apresentam mesma quantidade de massa, mas diferem no número atômico, ou seja, diferem no número de prótons. Por exemplo:
Isótonos: apresentam mesma quantidade de nêutrons, mas diferem na massa e no número atômico (número de prótons). Por exemplo:
Nos vemos novamente no próximo resumo ;)




















